
Un “Lu pour vous” basé sur : “Population Pharmacokinetic Meta-Analysis of Five Beta-Lactam Antibiotics to Support Dosing Regimens in Dogs for Surgical Antimicrobial Prophylaxis” (Pelligand et al., 2024).*
*Dans l’article de Pelligand et al. (2024), les résultats de la partie Results diffèrent de ceux de l’Abstract et de la Table 3. Après avoir contacté l’auteur (Pelligand L., communication personnelle, 13-3-2025), il nous a été confirmé que les résultats de l’Abstract et de la Table 3 sont corrects. Une correction formelle de l’article original n’a pas encore été publiée dans The Veterinary Journal.
Introduction
Chez les animaux à haut risque d’infection chirurgicale (surgical site infections - SSI) ou lorsque les conséquences de telles infections sont potentiellement graves, les antibiotiques peuvent être administrés en péri-opératoire afin de diminuer le risque d’infection (Règlement UE 2016/6, art. 107).
Pelligand et al. (2024) ont étudié 5 antibiotiques intraveineux dans le cadre de la prophylaxie des infections chirurgicales chez le chien.
Les résultats de cette étude constituent une base scientifique sur laquelle les vétérinaires praticiens peuvent s’appuyer pour choisir un antibiotique de manière rationnelle et déterminer la dose et le schéma d’administration dans le cadre de la prophylaxie chirurgicale.
Sujet et principaux résultats de l'étude
- Pelligand et al. (2024) ont étudié 5 antibiotiques intraveineux pour la prévention des infections chirurgicales chez le chien. La prophylaxie était spécifiquement dirigée contre Staphylococcus pseudointermedius (bactérie dominante du microbiote cutané) et Escherichia coli (bactérie dominante du microbiote gastro-intestinal).
- D’après une méta-analyse pharmacocinétique et un modèle PK/PD, ils ont étudié, pour chaque antibiotique, le timing optimal de la première administration préopératoire et l’intervalle entre 2 doses pendant l’opération (voir aussi Annexe 1 : A propos de la méthode de l’étude). Les résultats de cette étude sont fournis dans le Tableau 1.
Tableau 1 : Résumé des résultats obtenus par Pelligand et al. (2024) pour le dosage et le timing de l’administration des antibiotiques en prophylaxie chirurgicale chez le chien.
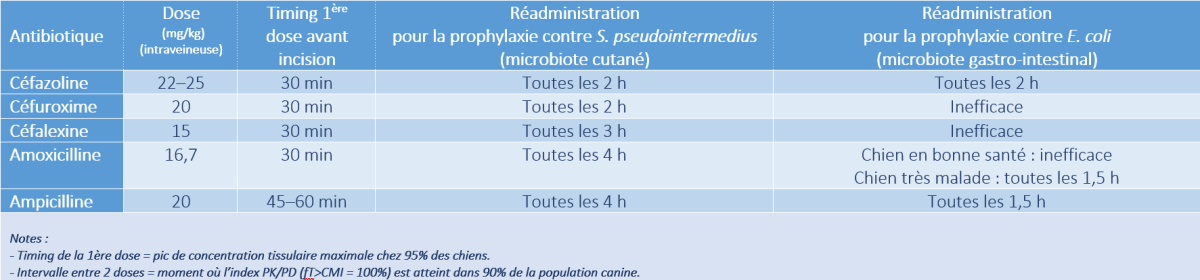
- Ces résultats doivent être validés par des études cliniques ultérieures.
- Actuellement, aucun médicament vétérinaire n’est indiqué pour la prophylaxie des infections chirurgicales.
- Ces résultats offrent au vétérinaire une base scientifique sur laquelle appuyer la prophylaxie antibiotique périopératoire chez le chien, dans les conditions de la cascade.
- Les résultats ci-dessus ne sont pas applicables à d’autres espèces animales.
Voir aussi e-learning « Prophylaxie antimicrobienne : est-ce encore autorisé ? ».
Que signifie cette étude pour la pratique ? – Réflexions du CBIP
Dans la majorité des interventions chirurgicales, notamment les interventions électives chez des animaux en bonne santé, une asepsie opératoire correcte sera suffisante pour éviter les SSI.
Lorsqu’une prophylaxie antibiotique est nécessaire pour une intervention, l’antibiotique doit être sélectionné et administré de manière rationnelle (spectre, dose, timing de la première administration et intervalle entre 2 doses).
Les résultats de cette étude constituent une base scientifique robuste sur laquelle le vétérinaire praticien peut s’appuyer pour choisir un antibiotique, la dose et le schéma d’administration en cas de prophylaxie antibiotique chirurgicale chez le chien. Voir aussi Annexe 2 « Evaluation des preuves scientifiques ».
Les résultats de cette étude ne sont pas applicables à la prophylaxie des SSI chez d’autres espèces animales car la cinétique de l’antibiotique, les pathogènes impliqués et leur sensibilité peuvent varier d’une espèce à l’autre. Par exemple, chez le chat, les principales bactéries de la flore cutanée ne sont pas des Staphylococcus spp. mais des Bacteroides spp. (Devriendt et al., 2023).
Les céphalosporines de cette étude appartiennent aux 1ère et 2ème générations et ne sont pas considérées comme critiques pour l’homme (code couleur AMCRA jaune). L’ampicilline et l’association amoxicilline-acide clavulanique devraient être évitées dans la mesure du possible (par exemple au profit des céphalosporines de 1ère et 2ème générations) et leur utilisation responsable doit être basée sur un antibiogramme (code couleur AMCRA orange) (EMA, 2025).
Aucun médicament vétérinaire n’est actuellement indiqué pour la prophylaxie des SSI. Le vétérinaire devra donc faire appel à la cascade. La céfalexine, l’amoxicilline et l’ampicilline sont disponibles sous forme injectable (voir le Vetcompendium pour les médicaments vétérinaires belges et l’UPD pour tous les médicaments vétérinaires de l’UE). La céfazoline et le céfuroxime ne sont commercialisés que comme médicaments à usage humain (voir www.cbip.be).
Annexe 1 : A propos de la méthode de l'étude
Pelligand et al. (2024) ont utilisé des paramètres pharmacodynamiques (PD) et pharmacocinétique (PK) de population pour déterminer le schéma d’administration optimal des cinq antibiotiques (bêta-lactames).
Une étude précédente a montré que ces antibiotiques étaient couramment utilisés en prophylaxie des SSI chez le chien et le chat malgré de grandes variations dans les schémas d’administration (Sørensen et al., 2024).
Pelligand et al. (2024) ont réalisé des méta-analyses à partir de plusieurs études PK où au moins l’un des cinq antibiotiques a été administré en intraveineuse chez des chiens. Les résultats de ces méta-analyses ont ensuite été utilisés pour simuler l’évolution des concentrations plasmatiques de chaque antibiotique chez 5000 chiens virtuels, avec une simulation de Monte-Carlo.
Le timing de la 1ère administration préopératoire a été déterminé à partir du moment où la concentration tissulaire maximale de l’antibiotique était atteinte chez 95% des chiens virtuels.
L’index PK/PD des antibiotiques temps-dépendants comme les bêta-lactames est le % de l’intervalle entre 2 doses où la concentration plasmatique de l’antibiotique reste supérieure à la concentration minimale inhibitrice (CMI) : T>CMI. Cette étude a investigué pour chaque antibiotique si sa concentration tissulaire restait supérieure à la CMI chez au moins 90% des chiens pendant toute la durée de l’intervalle (T>CMI = 100%). Les intervalles suivants ont été étudiés : 1,5 h ; 2 h ; 3 h et 4 h après la 1ère dose.
Comme données PD, les valeurs seuils épidémiologiques (ECOFF – les valeurs de CMI les plus élevées dans la population sauvage) pour S. pseudointermedius (contaminant principal issu de la flore cutanée) et E. coli (contaminant gastro-intestinal principal), publiées par EUCAST, ont été utilisées.
Les modèles PK/PD comme ci-dessus utilisent les propriétés pharmacocinétiques de l’antibiotique et les paramètres pharmacodynamiques liés à l'action de l'antibiotique sur le pathogène pour déterminer de manière rationnelle le dosage optimal d'un antibiotique tout en minimisant le risque de développement d'une résistance (Rodríguez-Gascón et al., 2021).
Voir aussi « Médicaments antibactériens à usage systémique » et Folia Veterinaria « Frapper tôt, fort et longtemps : un vieux dogme de l’antibiothérapie revisité par les avancées scientifiques les plus récentes ».
Annexe 2 : Evaluation des preuves scientifiques
Les résultats de cette étude sont basés sur la modélisation d’une population PK/PD de 5000 chiens virtuels. Cela a permis aux chercheurs de tenir compte des variations PK interindividuelles dans une population canine relativement grande. La PK/PD est essentielle pour déterminer le dosage des antibiotiques car cela détermine la balance optimale entre l’élimination efficace des bactéries et la minimisation du développement de résistances, grâce à une concentration et une fréquence d’administration correctes (Rodríguez-Gascón et al., 2021).
Dans leur modèle, Pelligand et al. (2024) ont utilisé les valeurs ECOFF de l’EUCAST car elles donnent une meilleure représentation de la situation en cas d’infection chirurgicale que les valeurs de CMI individuelles. ECOFF définit la valeur la plus élevée dans la population bactérienne sauvage, avant l’apparition de mécanismes de résistance. Ceci est crucial en contexte périopératoire, où il s’agit de prévenir la colonisation et les infections bactériennes et non de traiter une infection causée par des bactéries résistantes. Les valeurs de CMI, en revanche, varient fortement entre les isolats bactériens individuels et peuvent être influencées par une résistance préexistante. En utilisant ECOFF, le dosage est basé sur la sensibilité attendue des pathogènes opportunistes du champ opératoire, ce qui permet une meilleure prévention des infections et d’éviter une exposition inutile aux antibiotiques – ce qui peut favoriser une résistance.
Les valeurs ECOFF pour S. pseudointermedius n’étaient pas disponibles pour tous les antibiotiques (seulement pour le céfuroxime, la céfazoline et l’ampicilline). Dans ces cas-là, des valeurs ECOFF de substitution ont été choisies (Staphylococcus aureus).
L’étude s’est limitée à 2 pathogènes importants qui causent des SSI chez le chien (S. pseudointermedius et E. coli). Les résultats de l’étude dépendent à la fois du pathogène et de l’espèce animale.
Ils offrent une base scientifique mais doivent être validés lors d’études cliniques ultérieures.
Bibliographie
Devriendt N., M. F. (2023). Antimicrobial prophylaxis in canine and feline surgery. Vlaams Diergeneeskundig Tijdschrift, 92: https://openjournals.ugent.be/vdt/article/id/87487/download/pdf/
EMA. (2025, 03 14). Categorisation of antibiotics used in animals promotes responsible use to protect public and animal health. Opgehaald van www.ema.europa.eu: https://www.ema.europa.eu/en/news/categorisation-antibiotics-used-animals-promotes-responsible-use-protect-public-and-animal-health
Paeckel N, Z. Y.-L. (2024). The effect of peri- and postoperative antibiotic prophylaxis on surgical site infection in surgeries with elective antibiotic administration. Veterinary Journal, p. Dec;308:106267. doi: 10.1016/j.tvjl.2024.106267. Epub 2024 Nov 15. PMID: 39549932: https://www.sciencedirect.com/science/article/pii/S1090023324002065/pdfft?md5=b83530247b5ee12c0e9c0b22a9e04de9&pid=1-s2.0-S1090023324002065-main.pdf
Pelligand L, M. S. (2024). Population pharmacokinetic meta-analysis of five beta-lactams antibiotics to support dosing regimens in dogs for surgical antimicrobial prophylaxis. Veterinary Journal, Jun;305:106136. doi: 10.1016/j.tvjl.2024.106136. Epub 2024 May 15. PMID: 38759725: https://www.sciencedirect.com/science/article/pii/S1090023324000753?via%3Dihub
Rodríguez-Gascón A, S. M. (2021). The Role of PK/PD Analysis in the Development and Evaluation of Antimicrobials. Pharmaceutics., Jun 3;13(6):833. doi: 10.3390/pharmaceutics13060833. PMID: 34205113: https://www.mdpi.com/1999-4923/13/6/833
Sørensen TM, S. K. (2024). Antimicrobial prophylaxis in companion animal surgery: A scoping review. Veterinary Journal, Apr;304:106101. doi: 10.1016/j.tvjl.2024.106101. Epub 2024 Mar 14. PMID: 38490359: https://www.sciencedirect.com/science/article/pii/S1090023324000406/pdfft?md5=a25954bde311352457c88799c98eceec&pid=1-s2.0-S1090023324000406-main.pdf