
Les effets indésirables mentionnés dans la notice/RCP du Librela ont été modifiés après la publication de cet article : voir «Adaptation du profil de sécurité du Librela».
Depuis son approbation pour le traitement de la douleur chronique chez le chien atteint d’ostéoarthrite (OA), le Librela (bedinvetmab) s’est fait une place en médecine vétérinaire. Il a été commercialisé en Europe et au Royaume Uni en 2021 et au Canada, en Australie et aux USA 2 ans plus tard.
Le bedinvetmab, un anticorps monoclonal canin, inhibe le nerve growth factor (NGF), ce qui bloque la transmission des stimuli nociceptifs. Grâce à ce nouveau principe de fonctionnement, il constitue, avec les AINS, une base dans le traitement de l’OA.
Cependant, l'inquiétude croît quant à la sécurité du Librela, y compris chez les vétérinaires belges, suite à la publication de messages négatifs sur les réseaux sociaux et dans la presse. Une « Dear Veterinarian Letter » de l’Agence américaine des médicaments (FDA) fin 2024 et des publications dans plusieurs revues spécialisées (entre autres AVMA ; AAHA) ont suivi.
L’efficacité et la sécurité du beddinvetmab ont déjà été abordées dans un autre article Folia : Folia Veterinaria de mai 2023, mis à jour en février 2025.
Dans cet article, nous discuterons des données récentes sur la sécurité du Librela et nous fournirons une estimation étayée scientifiquement des risques potentiels liés à ce produit, en particulier ceux d’ordre musculo-squelettique.
Nous nous basons sur deux publications récentes :
- Global pharmacovigilance reporting of the first monoclonal antibody for canine osteoarthritis: a case study with bedinvetmab (Librela™) (Monteiro et al., 2025) - Lisez l'article.
Cette étude a été réalisée à la demande de Zoetis, le titulaire d’autorisation du Librela. - Musculoskeletal adverse events in dogs receiving bedinvetmab (Librela) (Farrell et al. (2025) - Lisez l'article.
A quels effets indésirables faut-il s’attendre avec le Librela ?
Le profil de sécurité d’un médicament vétérinaire est surveillé en permanence grâce au système de pharmacovigilance. Le titulaire d’autorisation et les autorités, qui reçoivent, enregistrent et évaluent les effets indésirables, peuvent prendre des décisions destinées à garantir la sécurité d’un médicament. Voir aussi : Notifier un effet indésirable.
Monteiro et al. (2025) décrivent la nature et la fréquence (nombre de notifications/doses vendues) des effets indésirables potentiels du Librela, dans le monde entier, et enregistrés par Zoetis (titulaire d’autorisation) entre le 1er février 2021 et le 30 juin 2024 dans la Zoetis Global Pharmacovigilance-database.
Les 20 effets indésirables les plus signalés pour le Librela dans le monde entier étaient rares (1-10/10.000 animaux traités (doses)) ou très rares (<1/10.000 animaux traités (doses)), selon Monteiro et al. (2025).
Rarement signalés :
- Un manque d’efficacité était le plus souvent signalé (1,70/10.000 animaux traités (doses)).
- Polydipsie, ataxie, polyurie/pollakiurie, anorexie, léthargie, mort et émèse.
Très rarement signalés :
- Diarrhée, incontinence urinaire, faiblesse musculaire, convulsions, tremblements musculaires, tachypnée, infections urinaires, parésie, signes musculo-squelettiques non précisés, hyperactivité, augmentation du BUN et boiterie.
Les notifications diffèrent, selon la région, en termes de fréquence et de type d’effet indésirable et peuvent augmenter ou diminuer au cours du temps dans une même région.
Bien que les causes de ces effets indésirables soient généralement hypothétiques, les auteurs, qui sont des employés ou des consultants de Zoetis, attribuent en grande partie l’augmentation du nombre de signalements d’ataxie à la couverture médiatique négative du Librela. Il est cependant peu probable qu’il s’agisse d’un phénomène de surdéclaration. La pharmacovigilance repose sur le signalement volontaire, principalement des vétérinaires, ce qui donne lieu à une large sous-déclaration (N. De Briyne, 2017). En outre, les auteurs ne questionnent pas l’authenticité des notifications.
Pour chaque rapport, une enquête de causalité évalue le lien potentiel entre les effets indésirables signalés et le médicament utilisé. Une augmentation soudaine des signalements d’un effet indésirable ou un nombre de notifications anormalement élevé par rapport à des médicaments comparables constituent un signal pour étudier et évaluer plus en détail la possibilité d’un lien de cause à effet entre l’effet indésirable et le médicament.
Selon Monteiro et al. (2025), la causalité est souvent difficile ou impossible à évaluer. Des facteurs propres à la population âgée traitée pour l’OA, comme des comorbidités et l’usage concomitant d’autres médicaments (AINS ou autres), ou le manque d’informations objectives (ex. état clinique avec évaluation de la douleur objective et imagerie médicale avant et après traitement) complexifient souvent, selon eux, l’enquête de causalité.
Malgré ces difficultés, de nouveaux risques ont été récemment identifiés, conduisant à l’adaptation des informations de produit du Librela : ataxie, ataxie proprioceptive, incontinence urinaire, anorexie et léthargie ont été ajoutées comme effets indésirables (Monteiro et al., 2025). Voir aussi article Folia « Quelles nouvelles de la pharmacovigilance européenne en 2024 ? ».
La Figure 1 reprend les effets indésirables mentionnés dans la notice/RCP européenne (consultée le 19/06/2025).
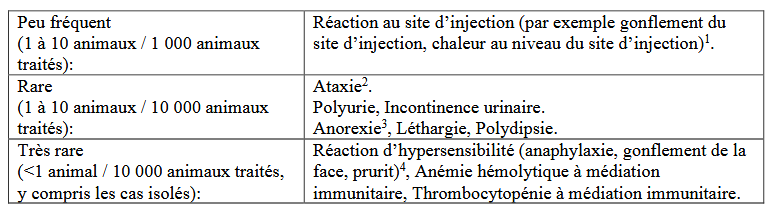
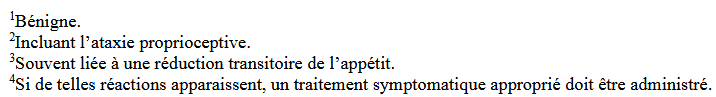
Figure 1 : Effets indésirables repris dans la notice/RCP européenne du Librela au moment de la publication de cet article (consultée le 19/08/2025).
En juillet 2025, l’Agence Européenne des Médicaments (EMA) a décidé d’examiner les risques potentiels d’affections musculo-squelettiques après utilisation du Librela, qui ne sont pas dans les informations de produit. Il a été demandé au titulaire d’autorisation Zoetis « d’effectuer une analyse approfondie de toutes les informations disponibles sur les affections musculo-squelettiques suspectées et mentionnées depuis l’autorisation du médicament ». Fin 2025, l’EMA se penchera sur les résultats de cette analyse et sur toutes les données disponibles pour déterminer si d’autres actions, comme l’adaptation des informations de produit, sont nécessaires (CVMP, 2025).
Y a-t-il un lien de cause à effet entre le Librela et des effets indésirables musculo-squelettiques (EIMS) graves ?
Des études cliniques chez l’humain mentionnent l’ostéo-arthrite rapidement progressive (RPOA, Rapidly Progressive Osteoarthritis) chez des patients traités avec des anticorps monoclonaux anti-NGF humanisés. Le risque de RPOA augmente si les doses administrées sont élevées et chez les patients traités concomitamment avec des AINS pendant une longue période (Wise BL, 2021).
Le mécanisme d’apparition de la RPOA en cas d’utilisation d’inhibiteurs du NGF n’est pas connu. La perturbation du rôle positif du NGF sur la régénération des os et du cartilage est une hypothèse possible (Wise BL, 2021).
Etant donné les similitudes biologiques, pathophysiologiques et pharmacologiques entre l’humain et le chien, des lésions articulaires comparables chez le chien ne sont pas à exclure.
Monteiro et al. (2025) et Farrell et al. (2025) ont étudié l’apparition et les signes d’EIMS et de RPOA chez le chien après administration du Librela.
Monteiro et al. (2025) ont cherché, dans la base de données de Zoetis, les notifications pouvant être liées à la RPOA et ont sélectionné, sur base de mots-clés, toutes les notifications d’EIMS et avec radiographies. Les mots-clés utilisés étaient : ‘RPOA (Rapidly Progressive OA)’, ‘rapid’, ‘progress’, ‘fracture’, ‘radiograph’, ‘arthritis’, ‘bone en joint disorder NOS (Not Otherwise Specified)’ et ‘joint pain NOS’).
Parmi les notifications retenues (2.404 au total), 25% ont été classées comme « manque d’efficacité » ou « progression de l’OA ». Selon les auteurs, aucun des cas signalés ne répondait aux critères de la RPOA chez l’humain. La causalité n’a pas pu être évaluée pour 6% des notifications et d’autres effets indésirables étaient mentionnés dans 69% des notifications.
La notice/RCP actuelle du Librela indique que, chez l’humain, un risque de RPOA plus élevé existe mais qu’il n’y a pas d’équivalent décrit chez le chien.
Cependant, Farrell et al. (2025) ont montré que, pour le Librela, les EIMS, comme les lésions ligamentaires et tendineuses, la polyarthrite, les fractures, les néoplasies musculo-squelettiques et l’arthrite septique, étaient rapportés environ neuf fois plus souvent que pour 6 autres médicaments vétérinaires comparables pris ensemble, sur une période de 20 ans. Ils arrivent à cette conclusion suite à une étude de disproportionnalité pour laquelle ils ont comparé le nombre de notifications d’EIMS du Librela dans la Eudravigilance Veterinary Database (de la mise en service en 2004 au 31/12/2024) avec celles de 6 AINS indiqués pour le traitement de l’OA chez le chien : Rimadyl, Metacam, Previcox, Onsior, Galliprant en Daxocox.
Les notifications où le Librela était combiné à l’un des 6 AINS ou impliquant des pathologies neurologiques et/ou systémiques ou des néoplasies n’ont pas été retenues pour l’étude. Au total, 878 EIMS ont été mentionnés dont 789 (90%) pour le Librela.
Le fait que de nombreux effets indésirables (gastro-intestinaux) des AINS ne soient plus signalés, est négligeable dans cette analyse car la comparaison porte sur la somme de tous les EIMS signalés pour ces 6 AINS au cours de leur existence. De plus, les EIMS ne sont pas les effets indésirables les plus souvent associés aux AINS (Anti-inflammatoires – AINS).
Farrell et al. (2025) ont conclu que les notifications d’EIMS étaient plus fréquentes pour le Librela que pour des médicaments vétérinaires comparables mais ce n’est pas une preuve de lien causal. Pour leur étude, les auteurs ont sélectionné 19 chiens dont les EIMS ont été évalués par un panel de 18 experts.
Par analogie avec la définition de la RPOA humaine de l’Artritis Advisory Committee, ces experts ont défini la RPOA comme « une pathologie articulaire qui dépasse largement la progression naturelle de l’OA, avec notamment des fractures pathologiques ou des luxations des articulations ostéo-arthritiques et l'ostéolyse sous-chondrale en l'absence de preuve clinique d'arthrite septique ou à médiation immunitaire ».
Les 18 experts ont conclu à l’unanimité qu’il y avait une forte présomption de lien causal entre le traitement au Librela et les signes de RPOA observés : lésions ligamentaires et tendineuses, polyarthrite, fractures pathologiques, néoplasies musculo-squelettiques et arthrite septique (Farrell et al., 2025).
Deux chiens traités pour l’OA du coude ont développé une grave dégénérescence de l’articulation du genou, qui était cliniquement normale au début du traitement. Chez 13 des 19 chiens, les EIMS sont apparus après au moins 6 mois de traitement. L’examen histopathologique des tissus osseux et synovial de 4 chiens n’a montré aucun signe d'arthropathie inflammatoire, de pathologie transmise par les tiques ou de néoplasie.
Les chiens ont été traités à la dose recommandée. A une exception près, ils ont reçu un AINS (cimicoxib, méloxicam of carprofène) régulièrement (Eng. : regular) (11/19) ou de manière intermittente (Eng. : intermittant) (6/19).
Cette étude n’a pas évalué si et dans quelle mesure l’association de bedinvetmab et d’un AINS favorisait l’apparition d’EIMS, comme c’est le cas chez l’humain. La RPOA aurait aussi été signalée chez l’humain en cas d’utilisation d’AINS sans inhibiteurs du NGF (Wise et al., 2021; Monteiro et al., 2025). On peut se demander si c’est également un problème cliniquement pertinent en médecine vétérinaire.
Les conclusions de Farrell et al. (2025) semblent donc contredire celles de Monteiro et al. (2025).
L’absence de définition claire de la RPOA et la description limitée des résultats de recherche dans l’article de Monteiro et al. (2025), ainsi que les différences de méthodologie et de bases de données des deux études ne permettent pas une comparaison approfondie de leurs résultats.
Conclusion du CBIP
- Les anticorps monoclonaux inhibant le NGF, comme le bedinvetmab, forment une nouvelle classe d’analgésiques qui, avec les AINS et d’autres molécules apparentées comme le grapiprant, se sont fait une place dans le traitement de la douleur des chiens atteints d’OA.
- Les effets indésirables de la notice/RCP du Librela sont actuellement considérés comme rares ou très rares.
- Il y a des inquiétudes conséquentes quant au risque de RPOA chez les gens traités avec des anticorps monoclonaux anti-NGF et potentiellement aussi chez les chiens traités au Librela.
- Les données disponibles ne permettent pas de conclure à l’existence d’un lien causal entre le Librela et la RPOA chez le chien mais n’excluent pas ce risque non plus.
- Des études scientifiques indépendantes supplémentaires sur la sécurité du bedinvetmab sont nécessaires.
- Le signalement actif de tous les effets indésirables d’un médicament (avec autant d’informations cliniques objectives que possible) est essentiel à l’évaluation approfondie de ces effets indésirables.
Vous pouvez prendre les précautions suivantes si vous envisagez un traitement au Librela :
- Commencez le traitement après une évaluation orthopédique approfondie aux RX ou avec un autre type d’imagerie, évaluez la douleur avec des échelles validées et documentez la mobilité.
- Prenez connaissance des informations de produit du Librela quant aux :
- contre-indications et patients à risque : jeunes animaux < 12 mois, animaux reproducteurs, chiennes en gestation ou en lactation.
- interactions : l’utilisation du Librela avec des AINS n’a pas été assez étudiée que pour garantir la sécurité des patients avec OA.
- précautions particulières :
- Parfois, une réponse (suffisante) n'est observée qu'après une 2e dose. Lorsque le chien ne réagit toujours pas un mois après la 2e administration, le traitement doit être arrêté et un autre traitement mis en place.
- Avertissez les propriétaires que les chiens qui ont été moins actifs pendant une longue période à cause de l’OA ne doivent reprendre leurs activités physiques que progressivement.
- Informez les propriétaires qu’un manque d’efficacité ou une aggravation soudaine de l’état du chien sont possibles et que, dans ce cas, ils doivent vous contacter.
- Surveillez tous les patients, en particulier les vieux chiens avec comorbidités ou les chiens traités avec d’autres médicaments : contrôlez leurs confort, fonctionnalité et mobilité.
- Soyez attentif en cas d’usage prolongé.
- Soyez attentif à un épaississement/élargissement soudain des carpes et des tarses par exemple.
- Signalez tous les effets indésirables potentiels au titulaire d’autorisation ou à l’AFMPS. Donnez autant d’informations que possible dans le rapport de notification afin de permettre une enquête de causalité.
Bibliographie
- Farrell M, et al. (2025) Musculoskeletal adverse events in dogs receiving bedinvetmab (Librela). Front Vet Sci., May 9;12:1581490. doi: 10.3389/fvets.2025.1581490. PMID: 40417367; PMCID: PMC12100767.
- Monteiro BP, et al. (2025) Global pharmacovigilance reporting of the first monoclonal antibody for canine osteoarthritis: a case study with bedinvetmab (Librela™). Front Vet Sci., Apr 24;12:1558222. doi: 10.3389/fvets.2025.1558222. PMID: 40343372; PMCID: PMC12061024.
et
- Committee for Veterinary Medicinal Products (2025) Meeting highlights from the Committee for Veterinary Medicinal Products (CVMP) 15-17 July 2025 https://www.ema.europa.eu/en/news/meeting-highlights-committee-veterinary-medicinal-products-cvmp-15-17-july-2025
- De Briyne N., et al. (2017) Veterinary pharmacovigilance in Europe: a survey of veterinary practitioners . Veterinary Record Open, 4 (1) e000224; DOI: 10.1136/vetreco-2017-000224 https://www.fve.org/cms/wp-content/uploads/veterinary_pharmacovigilance_in_europe_a_survey_of_veterinary_practitioners.pdf.
- Wise BL, et al. (2021). The evolution of nerve growth factor inhibition in clinical medicine. Nat Rev Rheumatol., Jan;17(1):34-46. doi: 10.1038/s41584-020-00528-4. Epub 2020 Nov 20. PMID: 33219344